Камери для вертикального електрофорезу
Білковий електрофорез
Білковий електрофорез – це лабораторний метод для розділення білків за розміром молекули у гелі. Практично кожен експеримент, в якому досліджуються певні білки, включає в себе проведення електрофорезу. Такими дослідженнями є вивчення сигнальних шляхів при розгляді механізмів певних фізіологічних та паталогічних функцій організму тварин та рослин, а також бактерій та вірусів.
Даний метод використовується для:
-
- ● Визначення молекулярної маси білка, що досліджується;
- ● Перевірки наявності цільового білка у розчині;
- ● Розділення суміші білків;
- ● Очищення цільового білка;
- ● Вивчення гетерогенності і ступеня деградації протеїнів;
- ● Визначення, які субодиниці входять до структури білка.
Механізм роботи методу
Щоб постановити білковий електрофорез, окрім зразків необхідно мати:
- ● Камеру для електрофорезу;
- ● Джерело живлення;
- ● Гель;
- ● Витратні матеріали (буфери, барвники, маркери).
Принцип розділення білків полягає у тому, що кожна молекула має певний заряд. У камері за допомогою джерела живлення, яке має анодну та катодну пластинки, виникає електричне поле. Відповідно заряджені частинки рухаються до кінців з протилежним зарядом. Завдяки наявності гелю, у структурі якого є пори, білки з більшою молекулярною масою не можуть пройти в пори меншого діаметру. Такі білки зупиняються у верхній ділянці гелю. Білки з меншою молекулярною масою проходять більші відстані.
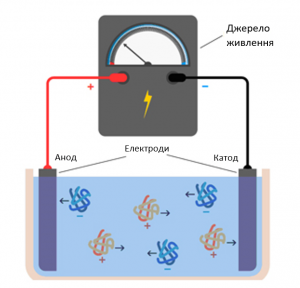
Рис. 1. Принцип функціонування білкового електрофорезу.
Швидкість руху протеїнів при електрофорезі може бути різною.
На цей показник впливають наступні фактори:
- ● Напруга поля. Підбираючи оптимальне джерело живлення та встановлюючи необхідні параметри, можна регулювати напругу поля.
- ● Заряд молекули інтересу. Цей показник залежить від pI молекули та pH розчину. Якщо pI > pH, то молекула є катіонною (мігрує до катода). Якщо pI < pH, то молекула аніонна (мігрує до анода). Якщо pI = pH, то молекула нейтральна (немає міграції в електричному полі). Тому ми можемо змінити швидкість міграції, а інколи і напрямок, змінивши рН розчину.
- ● Коефіцієнт тертя гелю. Цей параметр залежить від характеристик самого гелю та розміру його пор. Регуляція відбувається підбором оптимальної концентрації полімеризуючих агентів.
Гелева матриця для електрофорезу
Найбільш поширеною сполукою для виготовлення гелю для білкового електрофорезу є поліакриламід. Полімер складається з акриламіду та бісакриламіду. Останній забезпечує поперечне зшивання молекул акриламіду. Зазвичай співвідношення акриламід:бісакриламід становить 19:1. Відсоток вмісту акриламіду визначає розмір пор і, відповідно, максимально можливу масу білка, що можна розділити.
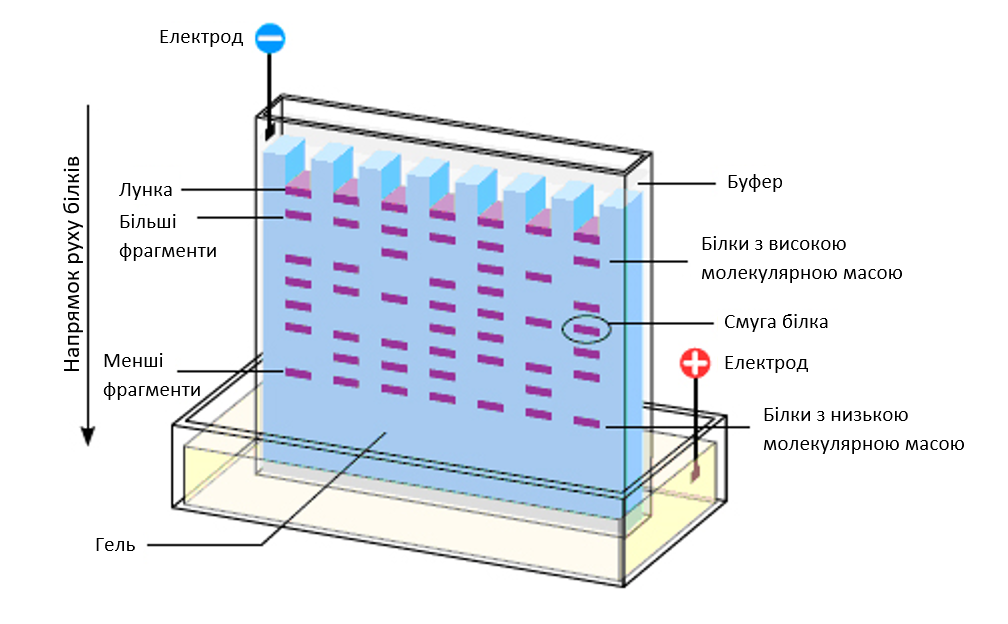
Рис. 2. Схема гелю з розподіленими у ньому протеїнами.
Візуалізація білків
Побачити білки без додаткових засобів у гелі неможливо, адже ці молекули не поглинають світло у видимому діапазоні. Тому до лунок, куди наносять зразок, додають барвник (зазвичай використовують бромфеноловий синій). Головними характеристиками, що має мати барвник, є малий розмір молекули та негативний заряд.
Завдяки малому розміру спостерігається фронт барвника, який випереджатиме фронт білків, що розділяються. Отже, барвник є маркером зупинки процесу. Коли забарвлений фронт досягає кінця гелю, електрофорез можна зупиняти.
Наступним етапом, де потрібно використовувати барвник, є візуалізація уже розділених білків. Найбільш поширеним барвником є Coomassie Brilliant Blue. Цей барвник зв’язується лише з протеїнами, тому його можна легко відмити від гелю і в результаті побачити смуги білків.
Окрім Coomassie Brilliant Blue використовують також і інші барвники, як срібло або SYPRO ruby, залежно від особливостей дослідження.
Визначення молекулярної маси
Найбільш зручним методом є використання маркерів, які необхідно додавати у сусідню лунку до зразків. Після проведення електрофорезу, порівнюючи розташування смуги білка інтересу з маркером, можна визначити приблизну молекулярну масу.
Типовий «стандарт молекулярної маси» включає наступну суміш білків:
| Білок | Молекулярна маса (кДа) |
|---|---|
| Фосфоліпаза В | 94 |
| Бичачий сироватковий альбумін | 67 |
| Овальбумін | 43 |
| Карбоангідраза | 30 |
| Інгібітор трипсину сої | 20,1 |
| Альфа-лактальбумін | 14,4 |
Проте варто зазначити, що є багато модифікацій для різних потреб.
Різновиди білкового електрофорезу
Є багато різновидів білкового електрофорезу. Найбільш часто використовують SDS-PAGE електрофорез. Таку популярність цей метод отримав завдяки тому, що при нагріванні білки денатурують і до них приєднуються молекули SDS.
Кількість молекул залежить від розміру білка. Таким чином білки отримують співвідношення негативного заряду відносно своєї маси. Електрофорез у такому разі залежить виключно від маси, адже інші критерії будуть однакові для всіх протеїнів у гелі.
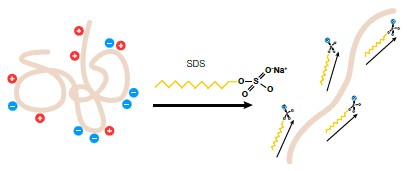 Рис. 3. Механізм функціонування SDS.
Рис. 3. Механізм функціонування SDS.
За таких умов концентрація акриламіду в гелі буде відповідати наступному діапазону розподілу білків:
| Акриламід, % | Межі ефективного розділення білків, кДа (к-сть амінокислот) |
|---|---|
| 8 | 25 - 200 кДа (225 - 1800) |
| 10 | 15 - 100 кДа (135 - 900) |
| 12,5 | 10 - 70 кДа (90 - 630) |
| 15 | 6 - 60 кДа (55 - 550) |
| 20 | 4 - 40 кДа (36 - 360) |
Окрім цього є :
- ● Градієнтний електрофорез (з різною щільністю гелю біля лунок для зразків та віддалено від них).
- ● Електрофорез без SDS (що дозволяє проводити розділення, враховуючи активність та інші властивості білків).
- ● SDS-PAGE з додаванням відновників (розривають дисульфідні зв’язки).
- ● Зимограмний електрофорез (для виявлення та характеристики протеаз).
- ● Ізоелектричне фокусування (розподіл за реакцією на електричне поле та рН).
- ● 2Д електрофорез (багатовимірний поділ, отримуємо інформацію про реакцію білка на рН, а потім розділяємо за молекулярною масою).
Камери для вертикального електрофорезу від Bio-Rad Laboratories:
Відображаються усі з 5 результатів
-

Камера для вертикального електрофорезу Criterion
Читати далі -

Камера для вертикального електрофорезу Criterion Dodeca
Читати далі -

Камера для вертикального електрофорезу Mini-PROTEAN
Читати далі -

Камера для вертикального електрофорезу Mini-PROTEAN 3 Dodeca
Читати далі -

Камера для електрофорезу Mini-PROTEAN з ручною заливкою гелю
Читати далі

